幸せ物質「オキシトシン」を可視化する技術とは:統合失調症などの治療活用へ
我々の脳内には多種多様な神経伝達物質があるが、いわゆる「幸せ物質」と呼ばれるオキシトシンもその一つだ。オキシトシンの作用は幸福感や愛情に関係するとされ、不安やストレスを緩和したり、食欲や代謝などをコントロールする。このオキシトシンが脳内でどんな振る舞いをしているのかを直接、観察できる技術を大阪大学と金沢大学の研究グループが開発した。
オキシトシンの役割とは
神経伝達物質は、脳内のニューロンから小さなツブツブとして放出される神経ペプチドだ。放出された神経伝達物質は、受容体が受け取り、それぞれの機能によって生物の行動や身体や精神の働きに影響をおよぼす。
オキシトシンもこうした神経ペプチドの一種で、実験動物による観察では性的な行動を強めたり、母性行動や社会的な共同行動の引き金になったりする(※1)。また、一夫一婦制のハタネズミにオキシトシンを注射すると、つがいの結びつきを促進する一方、遺伝子操作によってオキシトシンの受容体を失わせたマウスでは社会的な行動に障害が出たりする。
このため、オキシトシンは「幸せ物質」などと呼ばれ、脳内の自然な放出とは別に例えば鼻腔内にオキシトシンをスプレーし、自閉症スペクトラム障害や統合失調症などの治療に使用されている(※2)。だが、こうした治療法に効果があるのかどうか、脳内のオキシトシンがいつどこでどのように放出されているのかが直接、観察できないために懐疑的な意見も多かった(※3)。
リアルタイムでオキシトシン濃度を可視化
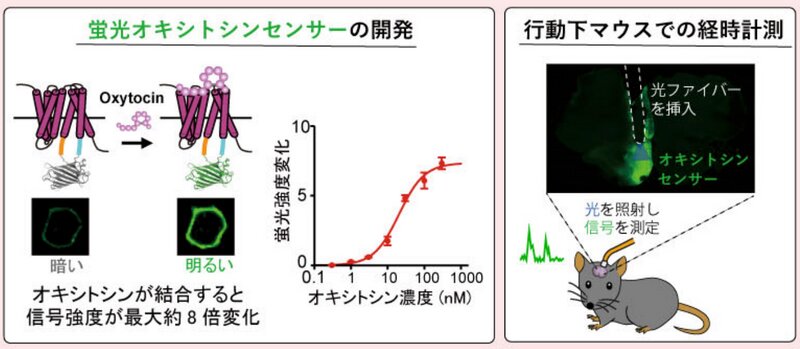
これまでマウスやラットなどの実験動物の脳内のオキシトシンを感度よくとらえることは難しかったが、今回、大阪大学大学院医学系研究科の稲生大輔特任講師、日比野浩教授、金沢大学医薬保健研究域医学系の西山正章教授らの研究グループが、生きた動物の脳内からオキシトシンを高感度に計測できる蛍光センサーを開発した(※4)。
この蛍光センサーは、蛍光タンパク質の遺伝的な指標をもとに、ファイバーフォトメトリという手法とデジタル顕微鏡によって神経伝達物質を観察するという最先端の技術を使っている。
蛍光タンパク質(cpGFP)は、2008年のノーベル化学賞を受賞した下村脩氏の発見によるクラゲ由来の蛍光タンパク質を改良したもので、これまで同様の技術によって、ドーパミン(※5)、認知などに関係するノルエピネフリン(※6)、運動機能や心血管機能、記憶力などに関係するアセチルコリン(※7)、睡眠に関係するアデノシン(※8)といった神経伝達物質の可視化技術が開発されてきた。
同研究グループは、メダカのオキシトシン受容体の遺伝子に蛍光タンパク質を埋め込み、オキシトシンが結合すると明るさが大きく変化する光センサーを開発した。そして、このセンサーをマウスの脳内へ導入し、外から入れられたオキシトシンがマウスの脳内でどのように振る舞うのかを定量的に記録した。また、外部から人為的に入れられたものではない、自然に脳内で放出されるオキシトシンの濃度制御についても観察することができた。
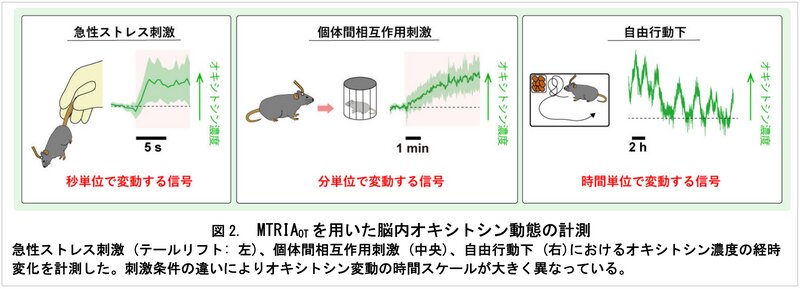
同研究グループによると、急性ストレス刺激、マウス同士の個体間の相互作用刺激といった刺激の違いによって、オキシトシンの脳内の濃度が時間的に変化することがわかったという。急性ストレス刺激では秒単位、マウス同士の相互作用刺激は分単位、自由行動は時間単位といったように、刺激や環境によってオキシトシンの濃度が変化する時間単位に違いがあった。
このオキシトシン・センサーの開発により、生きた動物の脳内のオキシトシンの濃度変化をリアルタイムで計測することが可能になった。オキシトシンを使った自閉症スペクトラム障害や統合失調症などの治療法や治療薬の開発に役立てることができ、また、脳以外の臓器に対するオキシトシンの役割の解明にもつながるのでは、と同研究グループは考えている。
※1:Hang Yu, et al., “Social touch-like tactile simulation activates a tachykinin 1-oxytocin pathway to promote social interactions” Neuron, Vol.110, Issue6, 1051-1067, 16, March, 2022
※2-1:Jennifer A. Bartz, Eric Hollander, “Oxytocin and experimental therapeutics in autism spectrum disorders” Progress in Brain Research, Vol.170, 451-462, 2008
※2-2:Joshua J. Green, Eric Hollander, “Autism and oxytocin: New developments in translational approaches to therapeutics” Neurothrapeutics, Vol.7, 250-257, 2010
※2-3:Hidenori Yamasue, et al., “Effect of a novel nasal oxytocin spray with enhanced bioavailability on autism: A randomised trial” BRAIN, Vol.145, Issue2, 490-499, 2, February, 2022
※3:Gareth Leng, Mike Ludwig, “Intranasal Oxytocin: Myths and Delusions” Biological Psychiatry, Vol.79, Issue3, 243-250, 1, February, 2016
※4:Daisuke Ino, et al., “A fluorescent sensor for real-time measurement of extracellular oxytocin dynamics in the brain” nature methods, doi.org/10.1038/s41592-022-01597-x, 22, September, 2022
※5-1:Fangmiao Sun, et al., “A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice” Cell, Vol.174, Issue2, 481-496, 12, July, 2018
※5-2:Tommaso Patriarchi, et al., “Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors” Science, Vol.360, Issue6396, 31, May, 2018
※6:Jiesi Feng, et al., “A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Vivo Detection of Norepinephrine” Neuron, Vol.102, Issue4, 745-761, 22, May, 2019
※7:Miao Jing, et al., “An optimized acetylcholine sensor for monitoring in vivo cholinergic activity” nature methods, Vol.17, 1139-1146, 28, September, 2020
※8:Wanling Peng, et al., “Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons” Science, Vol.369, Issue6508, 4, September, 2020


